Mục lục
A. Lí thuyết
I. Hiđroclorua
1. Cấu tạo phân tử
– Cặp electron bị lệch về phía clo do clo có độ âm điện lớn hơn hiđro

2. Tính chất
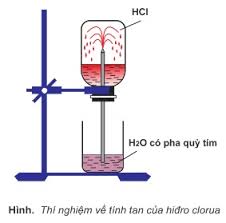
– Hiđroclorua là chất khí, không màu, tan nhiều trong nước (1 lít nước hòa tan 500 lít HCl)
– Hiđroclorua nặng hơn không khí
II. Axit Clohiđric (HCl)
1. Tính chất vật lý
– Ddd HCl = 1,19 g/cm3 (370C);
– Bốc khói trong không khí.
2. Tính chất hóa học
a. Tính axit mạnh
HCl là một axit mạnh, có đầy đủ tính chất điển hình của axit
– Làm đỏ quỳ tím
– Tác dụng với kim loại (trước H trong dãy điện hóa) sinh ra khí H2
– Tác dụng với bazơ thu được muối và nước
– Tác dụng với oxit bazơ thu được muối và nước
– Tác dụng với muối thu được muối mới và axit mới
b. Tính khử
Ví dụ:
.
3. Điều chế.
a. Trong phòng thí nghiệm
+ Phương pháp sunfat: (HBr và HI không dùng được cách này do có tính khử)
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl↑ (< 2500C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl↑ (> 4000C)
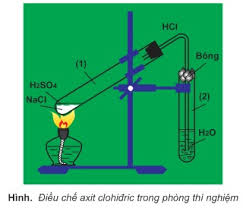
b. Trong công nghiêp (phương pháp tổng hợp)
– Đốt Cl2 và H2 lấy từ phương trình điện phân dung dịch NaCl
( ánh sáng, nhiệt độ)
– Clo hóa các hợp chất hữu cơ đặc biệt là hyđrocacbon.
III. Muối clorua và nhận biết muối clorua
1. Một số muối clorua
NaCl: làm muối ăn
ZnCl2: dùng làm chất chống mục
BaCl2: thuốc trừ sâu
KCl: phân bón
Đa số các muối clorua tan nhiều trong nước, trừ AgCl không tan, ít tan: CuCl, PbCl2.
Ứng dụng: (SGK)
2. Nhận biết ion clorua
Thuốc thử: dung dịch AgNO3
Phương pháp: cho vài giọt dd AgNO3 vào dung dịch cần phân biệt nếu có thấy xuất hiện kết tủa trắng không tan trong axit mạnh → HCl hoặc muối clorua.
B. Bài tập
1. Dạng 1: Lí thuyết về Hidroclorua – Axit clohidric và muối clorua
Câu 1. Nồng độ cao nhất của dung dịch HCl là
A. 25 %. B. 37%. C. 20%. D. 50%.
Đáp án B
Câu 2. Nhận xét nào sau đây về hidro clorua là không đúng?
A. Là chất khí ở điều kiện thường.
B. Có mùi xốc.
C. Tan tốt trong nước.
D. Có tính axit.
Đáp án D
Câu 3. Tính chất hóa học của axit HCl là
A. Tính axit mạnh. B. Tính khử.
C. Cả A và B. D. Tính oxi hoá.
Đáp án C
Câu 4. Khí hidro clorua có thể được điều chế bằng cách cho muối ăn (NaCl rắn) tác dụng với chất nào sau đây?
A. H2SO4 loãng. B. H2SO4 đặc.
C. NaOH. D. H2O.
Đáp án B
Câu 5. Để điều chế khí HCl trong công nghiệp, người ta sử dụng phương pháp:
A. Sunfat.
B. Tổng hợp.
C. Clo hoá các hợp chất hữu cơ.
D. Cả A, B, C đều đúng.
Đáp án D
2. Dạng 2: Bài tập tính toán về HCl
Câu 13. Hoà tan 6,75 gam hỗn hợp Al và Cu trong dung dịch HCl dư thu được 3,36 l khí (đktc). Phần trăm khối lượng của Al và Cu trong hỗn hợp là:
A. 30% và 70%. B. 40% và 60%.
C. 35% và 65% . D. 50% và 50%.
Đáp án B
Lời giải
Hòa tan hỗn hợp Al và Cu chỉ có Al tan trong HCl
2Al + 6HCl → 2AlCl3 + 3H2
0,1 0,15 mol
⇒ mAl = 0,1.27 = 2,7 gam ⇒ %Al = 40%, %Cu = 60%
Câu 14. Cho 16 gam hỗn hợp bột Fe và Mg tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 bay ra. Khối lượng muối clorua tạo ra trong dung dịch là bao nhiêu gam?
A. 33,75 gam. B. 51,5 gam.
C. 87 gam. D. kết quả khác.
Đáp án B
Lời giải
Đặt số mol của Mg là a mol và của Fe là b mol
Ta có hệ sau:
⇒ khối lượng muối clorua là m = 0,375.(24 +71) + 0,125.(56 + 71) = 51,5 gam.