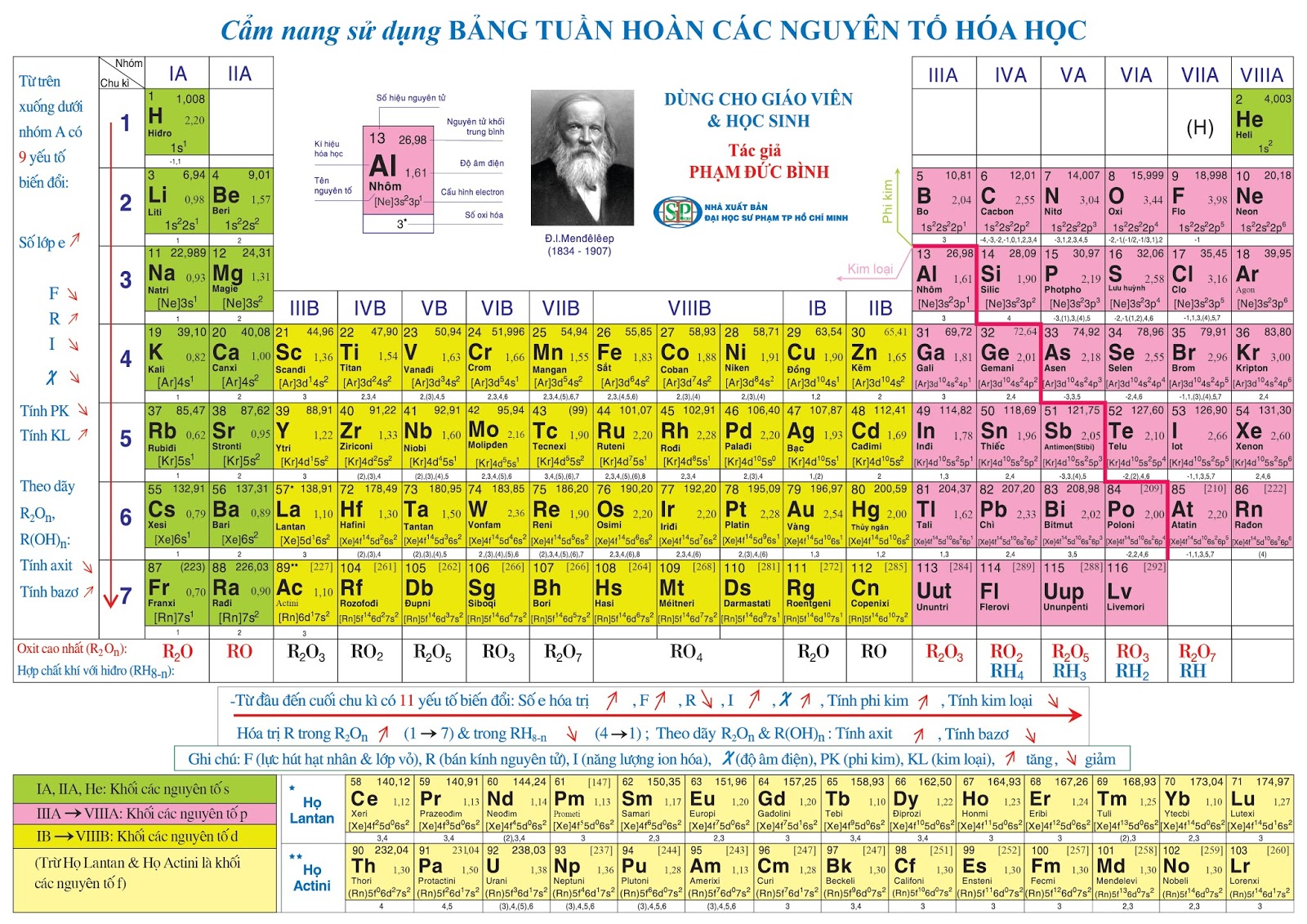
A. Lý thuyết:
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
– Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
– Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng (chu kì).
– Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột (nhóm).
II. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố:
– Mỗi nguyên tố hóa học được xếp vào một ô nguyên tố
– Trong ô có các thông tin cơ bản về nguyên tố đó
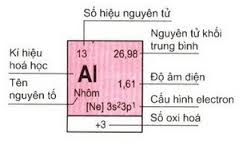
– Số thứ tự ô nguyên tố = số đơn vị điện tích hạt nhân (Z) = số proton = số electron trong nguyên tử
2. Chu kỳ
– Chu kì là dãy các nguyên tố của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần
– Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
– Bảng tuần hoàn hiện có 7 chu kì được đánh số từ 1 đến 7:
+ Chu kì 1, 2, 3: chu kì nhỏ.
+ Chu kì 4, 5, 6, 7: chu kì lớn.
3. Nhóm nguyên tố:
– Nhóm nguyên tố là gồm các nguyên tố có cấu hình electron lớp ngoài cùng tương tự nhau, nên tính chất hóa học gần giống nhau được xếp thành một cột.
– Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+ Nhóm A: bao gồm các nguyên tố s và p. Số thứ tự nhóm A = tổng số e lớp ngoài cùng
+ Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
* Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
* Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
– Các nguyên tố nhóm B là tập hợp các nguyên tố có electron hóa trị nằm trên phân lớp d và f.
B. Bài tập:
1. Dạng 1: Từ vị trí trong BTH xác định cấu hình e
Số thứ tự ô nguyên tố ⇒ số hiệu nguyên tử
Chu kì ⇒ Số lớp e.
Nhóm A ⇒ Số e hóa trị.
VD1: Nguyên tố ở chu kì 5, nhóm VIIA có cấu hình electron lớp ngoài cùng là
A. 4s24p5 B. 4d45s2 C. 5s25p5 D. 7s27p3
Lời giải:
Chu kì 5 ⇒ 5 lớp e. Nhóm VIIA ⇒ 7e ngoài cùng. Vậy cấu hình e lớp ngoài cùng là 5s25p5
Đáp án C.
2. Dạng 2: Từ cấu hình e xác định vị trí trong BTH
VD1: Nguyên tố M có cấu hình electron nguyên tử 1s22s22p63s2 3p64s1 vị trí của nguyên tố M trong bảng tuần hoàn là
A. Chu kì 4, nhóm IB B. Chu kì 3, nhóm IA
C. Chu kì 4, nhóm IA D. Chu kì 3, nhóm IIA
Lời giải:
Nguyên tố M có Z = 19, có 4 lớp e ⇒ thuộc chu kì 4, có 1 e ngoài cùng thuộc phân lớp s ⇒ thuộc nhóm IA.
Đáp án C.
Câu 2: Cấu hình e của ion X2+ là 1s22s22p6s23p63d6. Trong BTH các NTHH, nguyên tố X thuộc:
A. Chu kì 4, nhóm VIIIA B. Chu kì 4, IIA
C. Chu kì 3, VIA D. Chu kì 4, VIIIB
Lời giải:
Cấu hình e của X2+ 1s22s22p6s23p63d6 ⇒ cấu hình e của X là 1s22s22p6s23p63d64s2 ⇒ Z =26, chu kì 4 nhóm VIIIB vì e cuối cùng điền vào phân lớp d.
Đáp án D.