A. Lí thuyết
I. Flo
1. Tính chất vật lí và trạng thái tự nhiên.
– Chất khí, màu lục nhạt, rất độc:

Hình 1: Khí flo
– Hợp chất: + muối florua ví dụ CaF2
+ criolit: Na3AlF6…
2. Tính chất hoá học.
Có độ âm điện lớn nhất là tính oxi hoá mạnh nhất.
– oxi hoá tất cả kim loại.
– oxi hoá hầu hết các phi kim (trừ N2, O2).
Ví dụ:
Hiđro clorua (HF(k)) hoà tan trong nước tạo thành dung dịch axit clohiđric.
+ HF là axit yếu nhưng có thể ăn mòn thuỷ tinh:
– oxi hoá được nhiều hợp chất
ví dụ:
→ Kết luận: so sánh với clo, flo có tính oxi hoá mạnh hơn, mạnh nhất trong số các phi kim.
3. Ứng dụng, điều chế:
a. Ứng dụng: (SGK)
b. Sản xuất clo trong công nghiệp:
Điện phân nóng chảy hỗn hợp KF và HF
đpnc
2HF → F2 + H2
cực dương cực âm
II. Brom
1. Tính chất vật lí và trạng thái tự nhiên
– Chất lỏng, màu đỏ nâu, dễ bay hơi, hơi brom độc
– Hợp chất: NaBr trong nước biển…
2. Tính chất hoá học
– Brom có tính oxi hoá kém flo và clo nhưng vẫn là chất oxi hoá mạnh.
* oxi hoá được nhiều kim loại
Ví dụ:
(nhôm brromua)
* oxi hoá được hiđro ở nhiệt độ cao:
(hiđrobromua)
Tan trong nước tạo dung dịch axit bromhiđric → axit mạnh hơn, dễ bị oxi hoá hơn axit HCl
* Tác dụng rất chậm với nước:
Axit hipobromơ
→ Kết luận: So sánh với clo và flo thì brom có tính oxi hoá yếu hơn.
3. Ứng dụng và điều chế
a. Ứng dụng: (SGK)
b. Sản xuất brom trong công nghiệp.
III. Iot
1. Tính chất vật lí và trạng thái tự nhiên.
– Chất rắn, tinh thể màu đen tím.
– Hợp chất: muối iotua.
2. Tính chất hoá học.
– Iot có tính oxi hoá yếu hơn flo, clo, brom
* oxi hoá được nhiều kim loại nhưng phản ứng chỉ xảy ra khi đun nóng hoặc có chất xúc tác
Ví dụ:
* chỉ oxi hoá được hiđro ở nhiệt độ cao và có xúc tác:
Hiđro iotua tan trong nước tạo ra dung dịch axit iothiđric là axit mạnh hơn, dễ bị oxi hoá hơn axit HBr và axit HCl
– Hầu như không tác dụng với nước
– Có tính oxi hoá kém hơn clo, brom nên:
→ Tính chất đặc trưng:tác dụng với hồ tinh bột tạo thành hợp chất có màu xanh → nhận biết.
→ Kết luận: so sánh với clo, flo và brom thì iot có tính oxi hoá yếu hơn.
3. Nhận biết ion halogenua:
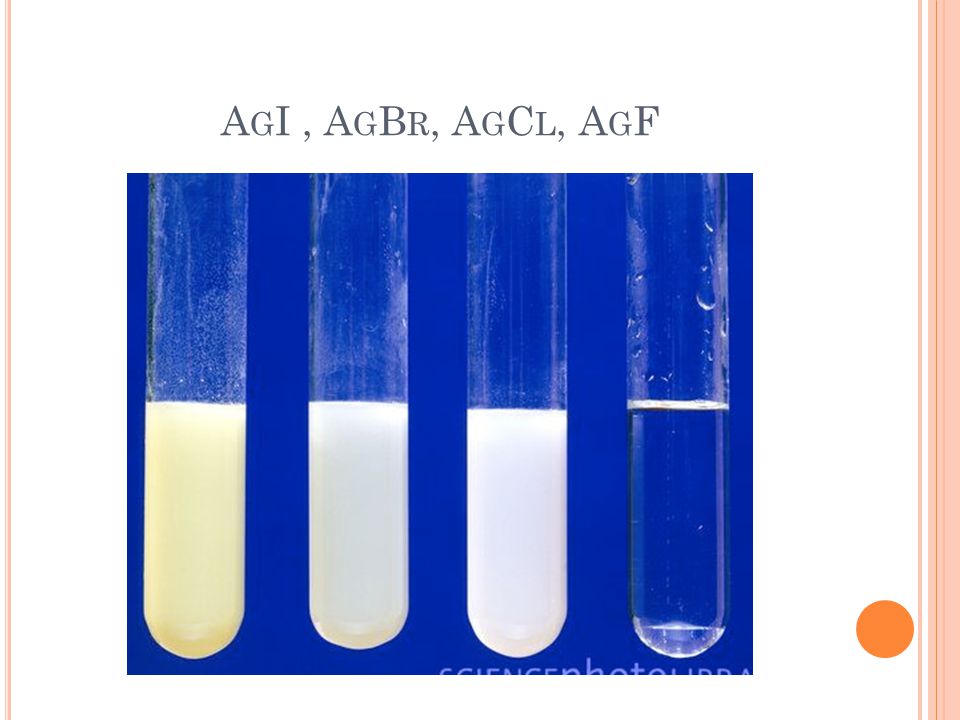
Sử dụng AgNO3 để nhận biết ion halogenua
F-: không tác dụng
Cl-: tạo AgCl↓ trắng
Br-: tạo AgBr↓ vàng nhạt
I-: tạo AgI↓ vàng
4. Ứng dụng và điều chế
a. Ứng dụng: (SGK)
b. Sản xuất iot trong công nghiệp:
– Từ rong biển