A.AMONIAC
I. Cấu tạo phân tử:
– CTPT : NH3
– CTe: H : N:H
..
H
– CTCT:
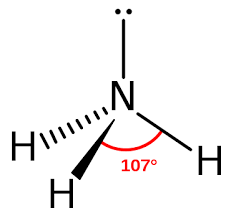
H – N – H
|
H
→ p/tử NH3 phân cực .
II. Tính chất vật lý:
– Là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí
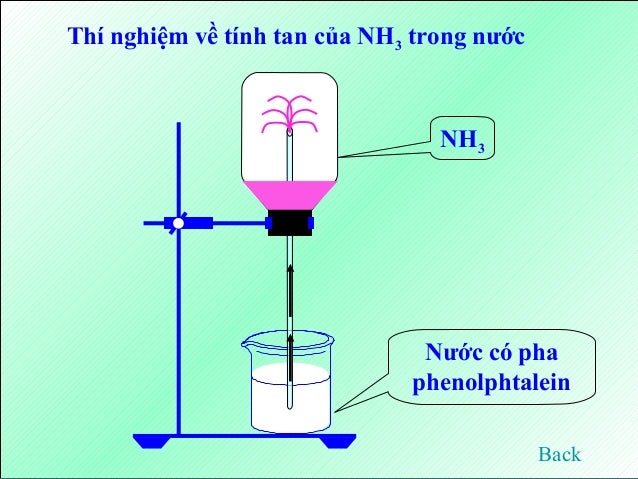
– Tan nhiều trong nước, tạo thành dd có tính kiềm
III. Tính chất hoá học:
1. Tính bazơ yếu:
a. Tác dụng với nước:
– Khi hoà tan khí NH3 vào nước, 1 phần các phân tử NH3 phản ứng tạo thành dd bazơ à dd NH3 là bazơ yếu:
NH3 + H2O → NH4++ OH-
– Làm quỳ tím chuyển sang màu xanh , phenoltalein từ trắng chuyển sang màu hồng:
b. Tác dụng với dung dịch muối:
– Dd NH3 có khả năng làm kết tủa nhiều hidroxít kim loại
AlCl3 + 3 NH3 + 3 H2O → Al(OH)3 + 3 NH4Cl
Al3++3NH3+3H2O → Al(OH)3+ 3NH4+
c. Tác dụng với axít :
2NH3 + H2SO4 → (NH4)2SO4
NH3 (k) (không màu) + HCl (k) (Không màu)→ NH4Cl (khói trắng)
2. Tính khử:
a. Tác dụng với oxi:
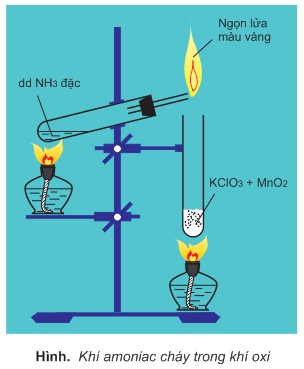
to
4 NH3 + 3O2 → 2N2 + 6 H2O
b. Tác dụng với Clo:
2 NH3 + 3Cl2 → N2 + 6 HCl
– Nếu NH3 dư
NH3 + HCl → NH4Cl (khói trắng)
* Kết luận: Amoniac có các tính chất hoá học cơ bản:
– Tính bazơ yếu
– Tính khử
IV. Ứng dụng:

– Ứng dụng chủ yếu của amoniac là điều chế phân đạm, điều chế axit nitric, là chất sinh hàn, sản xuất hiđrazin N2H4 dùng làm nhiên liệu cho tên lửa.
– Dung dịch amoniac còn được dùng làm chất tẩy rửa gia dụng.


V. Điều chế:
1. Trong PTN:
-Đun nóng muối amoni với Ca(OH)2 hay dd kiềm
to
2NH4Cl+Ca(OH)2→ CaCl2+2NH3 ↑+2H2O
-Để làm khô khí, ta cho khí NH3 có lẫn hơi nước qua bình vôi sống CaO.
-Điều chế nhanh 1 lượng nhỏ khí NH3, ta đun nóng dung dịch NH3 đậm đặc.
2. Trong CN:
to, P
N2 (k) + 3H2 (k) → 2 NH3 (k) , ΔH < 0
Xt
to: 450 – 500OC
P: 200- 300 atm
Chất xúc tác: Fe/Al2O3, K2O
B. Muối amoni:
-Muối amoni là chất tinh thể ion gồm cation amoni NH4+ và anion gốc axít.
Vd: NH4Cl, (NH4)2SO4 , (NH4)2CO3
I. Tính chất vật lý:
– Tinh thể
– Đều tan trong nước
– Ion NH4+ không màu
II. Tính chất hoá học:
1. Tác dụng với bazơ kiềm:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O.
PT ion thu gọn: NH4+ + OH- → NH3 + H2O
→ Điều chế NH3 trong PTN và nhận biết muối amoni.
2. Phản ứng nhiệt phân:
* Muối amoni tạo bởi axít không có tính oxi hoá: (HCl,H2CO3) → NH3

NH4Cl (r) → NH3 (k) + HCl (k).
(NH4)2CO3 (r) →NH3 (k) + NH4HCO3(r).
NH4HCO3(r) →NH3(k) + CO2(k) + H2O
* Muối amoni tạo bởi axít có tính oxi hoá: (HNO2, HNO3) → N2 , N2O
NH4NO2 →N2 + 2H2O
NH4NO3 → N2O + 2H2O
