I. Tính chất vật lý

– Khí màu vàng lục, mùi xốc, độc;
– Nặng gấp 2,5 lần không khí;
– Tan trong nước;
– Dung dịch Cl2 có màu vàng nhạt;
– Tan nhiều trong dung môi hữu cơ.
II. Tính chất hóa học
– Trong hợp chất với F hoặc O, Cl có số oxi hóa dương (+1, +3, +5, +7);
– Trong hợp chất với các nguyên tố khác clo có số oxi hóa là -1.
– Có khuynh hướng nhận 1e để thành ion Cl¯
– Vì vậy, tính chất hóa học cơ bản của clo là tính oxi hóa mạnh
1. Tác dụng với kim loại
– Clo phản ứng với hầu hết các kim loại trừ Au và Pt → muối halogenua. Các phản ứng thường xảy ra ở nhiệt độ cao. Muối thu được thường ứng với mức hóa trị cao của kim loại.
– Tốc độ phản ứng nhanh, tỏa nhiều nhiệt.
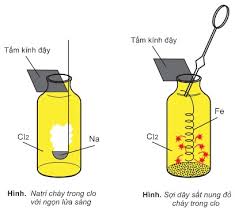
– Na nóng chảy cháy trong khí Cl2 với ngọn lửa màu sáng chói tạo ra NaCl:
– Cu tác dụng với Cl2
– Fe tác dụng với Cl2 tạo khói màu nâu là FeCl3
2. Tác dụng với hyđro
– Cl2 thể hiện tính oxi hóa khi tác dụng với H2 và kim loại
3. Tác dụng với nước
– Cl2 vừa là chất oxi hóa vừa là chất khử
– HClO là axit yếu nhưng có tính oxi hóa mạnh nên nước Cl2 có tính tẩy màu.
III. Trạng thái thiên nhiên
– Cl2 có 2 đồng vị bền: và
– Ở dạng hợp chất: chủ yếu là NaCl, cacnalit KCl.MgCl2.6H2O, HCl có trong dịch vị dạ dày người và động vật
IV. Điều chế
1. Điều chế khí Cl2 trong phòng thí nghiệm
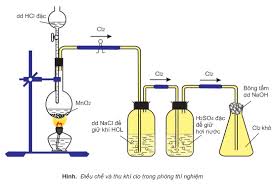
– Để giữ HCl và hơi nước.
2. Sản xuất Cl2 trong công nghiệp
– Điện phân dung dịch NaCl
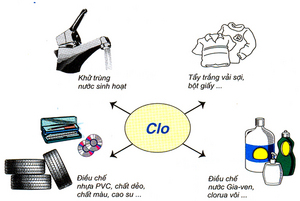
V. Ứng dụng
– Dùng diệt trùng nước sinh hoạt, tẩy trắng sợi, vải, giấy
– Sản xuất các hợp chất hữu cơ
– Dùng sản xuất chất tẩy trắng, sát trùng như nước Javen, clorua vôi, HCl, KClO3