1. Vị trí và cấu tạo





Li Na K Rb Cs
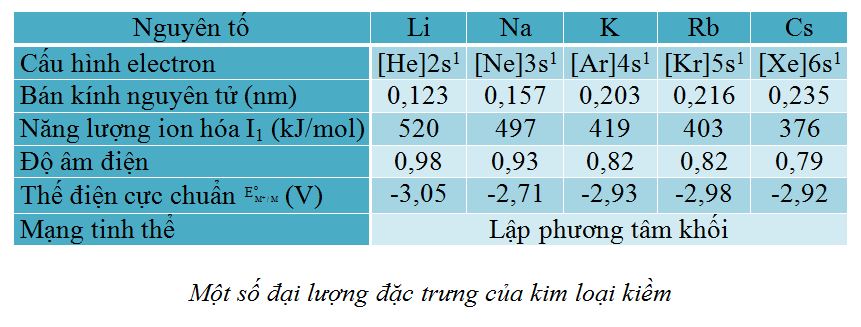
– Là nhóm nguyên tố có độ âm điện nhỏ nhất (năng lượng ion hoá I1 nhỏ nhất) nên thể hiện tính khử mạnh.
– Là nhóm nguyên tố có tính khử mạnh (ion của chúng có tính oxi hóa yếu) nên chúng chỉ được điều chế từ sự điện phân các muối clorua nóng chảy.
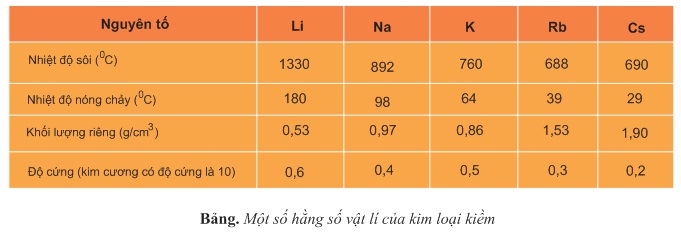
2. Tính chất vật lý
– Kim loại kiềm có màu trắng bạc, ánh kim, dẫn điện tốt.
– Nhiệt độ sôi, nhiệt độ nóng chảy và độ cứng của kim loại kiềm thấp.
– Đơn chất và hợp chất của mỗi kim loại kiềm có màu ngọn lửa đặc trưng: Liti: đỏ tím, Na: vàng ; K: tím ; Rb: đỏ huyết. Người ta thường dựa vào màu sắc trên dể nhận biết kim loại kiềm.
3. Tính chất hóa học
Kim loại kiềm là nguyên tố có tính khử mạnh (II thấp và E° có giá trị rất âm).
M – 1e → M+
Vì thế kim loại kiềm có khả năng phản ứng với các chất oxi hoá như phi kim, H+ (trong nước, trong axit) cation kim loại (trong oxit).
3.1. Tác dụng với phi kim
a. Tác dụng với oxi
– Ở nhiệt độ thường: tạo oxit có công thức M2O (Li, Na) hay tạo M2O2 (K, Rb, Cs, Fr).
– Ở nhiệt độ cao: tạo M2O2 (Na) hay MO2 (K, Rb, Cs, Fr) (trừ trường hợp Li tạo Li2O ).
b. Tác dụng với halogen
Phản ứng mãnh liệt với halogen (X2) tạo muối halogenua MX
2M + X2  2MX
2MX
3.2. Tác dụng với nước
Do hoạt động hóa học mạnh nên các kim loại kiềm phản ứng mãnh liệt với nước.
2M + 2H2O → 2MOH + H2
VD: 2Na + 2H2O → 2NaOH + H2↑
3.3. Tác dụng với dung dịch axit
2M + 2H+ → 2M+ + H2↑
| Sản phẩm khử | |
| HCl và H2SO4 loãng | H2 ↑ |
| H2SO4 đặc, to | H2S ↑ , S ↓ , SO2 ↑ |
| HNO3 loãng | NH4NO3, N2 ↑ , N2O ↑, NO ↑ |
| HNO3 đặc, to | NO2 (khí màu nâu) |
3.4. Tác dụng với dung dịch muối
Với cation kim loại của muối tan trong nước thì kim loại kiềm tác dụng với nước trước mà không tuân theo quy luật thông thường là kim loại hoạt động hóa học mạnh đẩy kim loại hoạt động hóa học yếu ra khỏi dung dịch muối.
VD: Cho kim loại Na vào dung dịch CuSO4 xảy ra các phản ứng
2Na + 2H2O → 2NaOH + H2↑
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
4. Ứng dụng, trạng thái tự nhiên, điều chế
4.1. Ứng dụng
– Chế tạo hợp kim có nhiệt độ nóng chảy thấp (hợp kim Na-K dùng làm chất trao đổi nhiệt trong lò phản ứng hạt nhân)
– Chế tạo hợp kim siêu nhẹ (Li-Al dùng trong hàng không)
– Xesi (Cs) sử dụng trong tế bào quang điện
4.2. Trạng thái tự nhiên
– Do khả năng hoạt động hóa học mạnh nên kim loại kiềm chủ yếu tồn tại trong tự nhiên dưới dạng hợp chất. (VD NaCl trong muối biển)
– Trong phòng thí nghiệm, kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
4.3. Điều chế
Vì có tính khử rất mạnh nên phương pháp thường dùng để điều chế các kim loại kiềm là điện phân nóng chảy muối halogenua của kim loại kiềm.
VD: NaCl  Na + 1/2Cl2
Na + 1/2Cl2